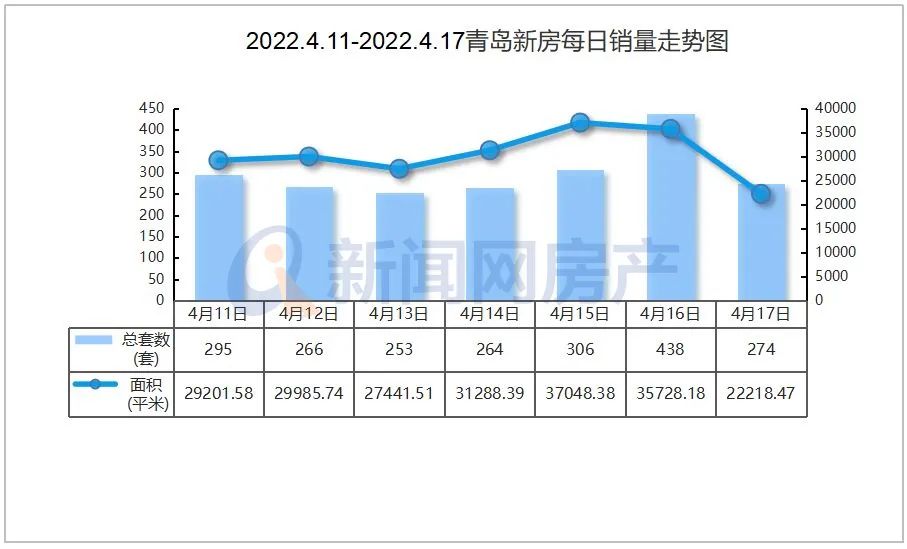
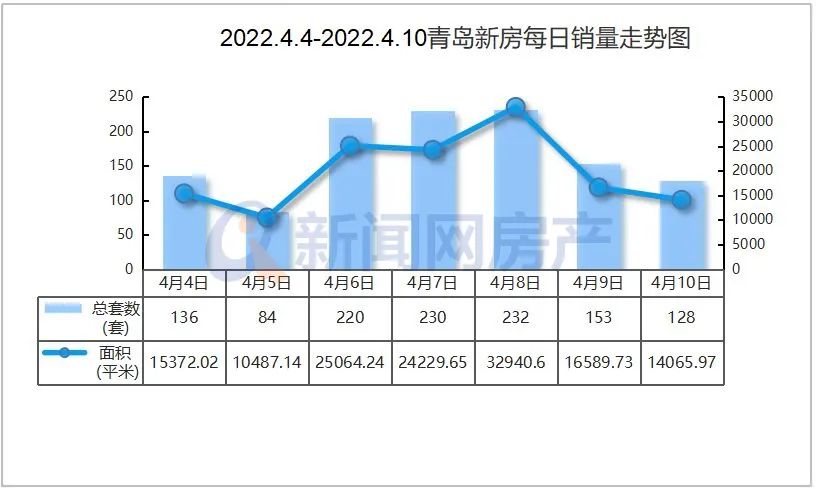
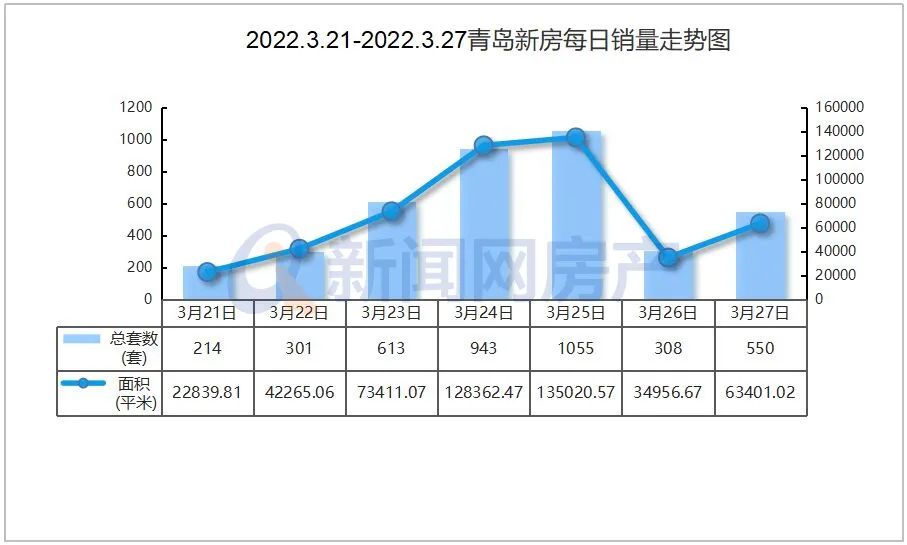
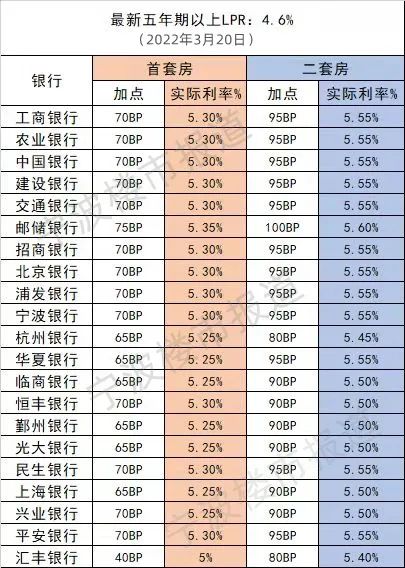
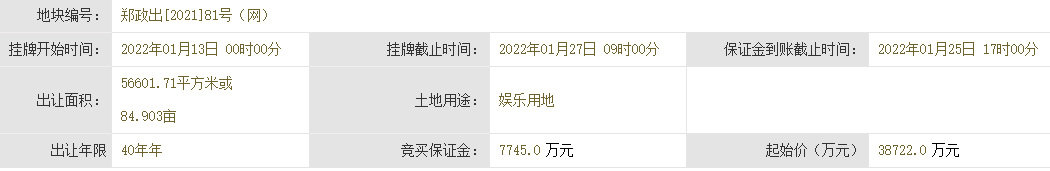
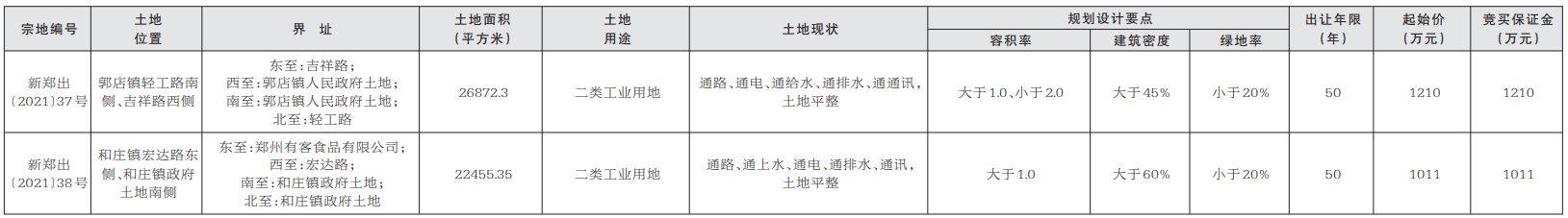
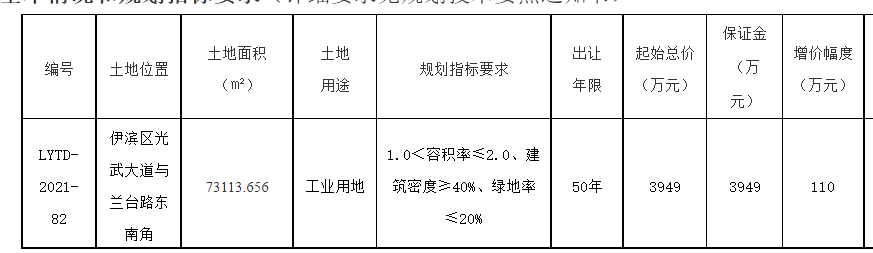
近日,由省藥物警戒中心主導制定的《藥品不良反應快速報告導則》(以下簡稱《導則》),經省市場監管局批準,作為河北省地方標準正式發布,成為我國首個藥物警戒工作方面的地方標準,填補了國內空白。
藥品不良反應是指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應。《藥品管理法》規定,“藥品上市許可持有人應當開展藥品上市后不良反應監測,主動收集、跟蹤分析疑似藥品不良反應信息,對已識別風險的藥品及時采取風險控制措施。”
《導則》適用于藥品上市許可持有人開展上市后藥品不良反應快速報告工作。《導則》明確,當持有人獲知嚴重藥品不良反應、藥品不良反應聚集性事件、藥品群體不良事件或其他嚴重安全性信息時,應該在規定的時間內向相關監測機構快速進行報告。嚴重不良反應盡快報告,不遲于獲知信息后的15日,其中導致死亡的嚴重藥品不良反應病例應在首次獲知后盡快報告。
《導則》規定,一份有效的報告應包括:可識別的報告者、可識別的患者、懷疑藥品、不良反應四要素。如果四要素不全,視為無效報告,應補充后再報。
《導則》的發布實施,對今后藥物警戒工作規范化建設具有積極指導意義,有利于藥品不良反應風險早發現、早報告、早評價、早處置,有利于強化藥品安全風險防控,更好保障藥品安全。(記者馬彥銘)
-
機動車檢驗、駕駛證換證可延長3個月辦理,河南省公安交管部門推出便民利企6項措施
頭條 22-04-24
-
哈爾濱公布首批400個重點項目,年度計劃投資560億元
頭條 22-04-24
-
開封一季度GDP增長5.3%,多項經濟指標增速高于全省
頭條 22-04-24
-
四川錦程消費金融總裁何德好任職資格,已獲四川銀保監局核準
頭條 22-04-24
-
三門峽市投資集團完成發行8億元中票,利率3.65%
頭條 22-04-24
-
河南建立省級重點企業“白名單”制度,全力保障產業鏈供應鏈暢通
頭條 22-04-24
-
河南將不斷完善優化應急物資中轉站工作預案
頭條 22-04-24
-
4月23日起,河南省全面啟動入豫貨車司乘人員報備系統
頭條 22-04-24
-
48h核酸陰性、綠碼,貨車直接放行!河南出臺“保通促穩十六條”
頭條 22-04-24
-
河南納入統計范圍9241戶企業1~2月利潤232.2億元,下降1.3%
頭條 22-04-24
-
海航集團風險處置相關工作順利完成
頭條 22-04-24
-
國家航天局:探月工程四期今年正式啟動工程研制
頭條 22-04-24
-
48小時核酸陰性、綠碼、體溫正常,貨車司機直接放行
頭條 22-04-24
-
要讓司乘人員有地方歇歇腳,不能總睡在車上
頭條 22-04-24
-
鄭州發布66號通告,二七區部分區域解封
頭條 22-04-24
-
河南推出十條措施推動文旅業復蘇:擬投資52億元推進2291個文旅項目
頭條 22-04-24
-
何雄會見中鐵七局集團有限公司總經理師建軍一行
頭條 22-04-24
-
廣東一季度GDP超2.8萬億元,同比增長3.3%
頭條 22-04-24
-
鄭州出租車不提醒乘客掃碼最長停運28天
頭條 22-04-24
-
上海昨日新增本土確診1401例,本土無癥狀感染者19657例
頭條 22-04-24
-
商丘最新通告:今日8時起全面恢復正常生產生活秩序
頭條 22-04-24
-
河南昨日新增本土確診6例、本土無癥狀感染者26例
頭條 22-04-24
-
轉型金融可以有更多想象空間|立方觀博鰲
頭條 22-04-24
-
國家衛健委:昨日新增本土確診病例1566例、本土無癥狀感染者20230例
頭條 22-04-24
-
梁萬年:躺平后的惡性循環將會是一場巨大災難
頭條 22-04-24
-
中國經濟一季報亮點:繼續疏通難點堵點
頭條 22-04-24
-
工信部:將加強信息共享和聯合懲戒 對存在突出問題的新能源汽車企業下發風險提示函
頭條 22-04-22
-
洛陽龍門旅游集團10億元私募債獲上交所反饋
頭條 22-04-22
-
三六零2021年利潤約9.02億元,政務安全類訂單毛利率約67.26%
頭條 22-04-22
-
雙重主要上市后,知乎要深耕內容賽道
頭條 22-04-22
-
AI機器人賺錢“牛”大發了!科大訊飛2021年報收183億元
頭條 22-04-22
-
河南省交通運輸發展集團擬發行15億元中票,用于償還有息債務
頭條 22-04-22
-
10到12名!三門峽市城建集團擬公開招聘專業人才
頭條 22-04-22
-
南陽發布重磅規劃:重點發展八大產業集群,支持黃志牧業集團上市
頭條 22-04-22
-
金額超億元!鄭東新區10項目擬獲中央財政支持住房租賃市場發展工作獎補
頭條 22-04-22
-
河南建設投資創新發展研究中心揭牌成立
頭條 22-04-22
-
鄭州路橋建設投資集團擬發10億元私募債,已獲上交所反饋
頭條 22-04-22
-
河南項城新增2例無癥狀感染者 系援建上海方艙醫院人員
頭條 22-04-22
-
80億凈利、超2100家機構調研,3500億醫療器械巨頭股價表現為何不佳?
頭條 22-04-22
-
三門峽國興產業投資基金擬設兩支子基金,面向全國公開遴選管理人
頭條 22-04-22
-
漯河郾城區新增1例無癥狀感染者 活動軌跡公布
頭條 22-04-22
-
洛陽市人民政府新任免一批國家工作人員
頭條 22-04-22
-
中國證券監督管理委員會投資者保護局原一級巡視員曾長虹被逮捕
頭條 22-04-22
-
被多家上市公司“碰瓷兒”!河南真實生物是一家什么樣的企業?
頭條 22-04-22
-
內蒙古自治區高級人民法院原黨組書記、院長胡毅峰被查
頭條 22-04-22
-
226家! 洛陽市首批“專精特新”企業名單出爐
頭條 22-04-22
-
南陽市委書記朱是西:將臥龍崗文化園建設成全國一流世界唯一的三國文化城
頭條 22-04-22
-
生豬市場“漲”聲響起 業內:警惕或是“曇花一現”
頭條 22-04-22
-
易綱:中國將繼續實施穩健的貨幣政策 加大對實體經濟的支持力度
頭條 22-04-22
-
河南昨日新增本土確診病例3例、本土無癥狀感染者14例
頭條 22-04-22
-
國家衛健委:昨日新增本土確診病例2119例 新增本土無癥狀感染者16383例
頭條 22-04-22
-
何雄會見國家電投河南公司總經理王捍忠
頭條 22-04-22
-
河南今年擬新增3個國家區域醫療中心
頭條 22-04-22
-
隔夜歐美·4月22日
頭條 22-04-22
-
鄭州鯤鵬軟件小鎮完成投資約102.5億元,計劃年底一期工程完工
頭條 22-04-22
- 河北出臺全國首個藥物警戒地方標準 填補了2022-04-24
- 河北省啟動體教融合標桿縣(市、區)創建工2022-04-24
- 河北縮短認定時間優化防貧監測幫扶機制 時2022-04-24
- 今年3月底 河北深層超采區地下水位平均埋2022-04-24
- 天津:下周不限號 嚴禁亂停車2022-04-24
- 天津調整中考體育統一測試方案 今年中考體2022-04-24
- 義務教育16科新課標發布 義務教育階段各門2022-04-24
- 北京增設會計正高級職稱 首次職稱申報工作2022-04-24
- 科學新發現:將人類的遺傳變異一網打盡!“2022-04-24
- 研究發現蘇鐵類植物通過增加葉片副轉輸組織2022-04-24
- 楊凱主持召開省影視動漫演藝專項推進組工作2022-04-24
- 銅陵市市場監管局探索實施監管新模式 促進2022-04-24
- 黃山市舉辦文創小鎮知識產權“入園惠企”沙2022-04-24
- 酒泉市嚴把農房建設概念性規劃設計關2022-04-24
- 桐城口罩 以質取勝2022-04-24
- 休寧中小學教師信息化素養全面“升級”2022-04-24
- 「縣市區」郎溪縣:試點“監督一點通” 打2022-04-24
- 延津縣人大常委會組織開展十五屆人大代表履2022-04-24
- 縣委書記李全喜深入鄉鎮督導檢查農村人居環2022-04-24
- 機動車檢驗、駕駛證換證可延長3個月辦理,2022-04-24
- 哈爾濱公布首批400個重點項目,年度計劃投2022-04-24
- 南陽市氣象局發布暴雨藍色預警「IV級/一般2022-04-24
- 山陽縣“師德頌—我的育人故事”演講賽2(2022-04-24
- 市領導赴原陽縣調研灘區遷建拆舊復墾工作2022-04-24
- 開封一季度GDP增長5.3%,多項經濟指標增速2022-04-24
- 四川錦程消費金融總裁何德好任職資格,已獲2022-04-24
- 狂風暴雨來襲!24日夜里到25日白天,河南這2022-04-24
- 三門峽市投資集團完成發行8億元中票,利率32022-04-24
- 快訊!河南省暴雨區:唐白河將出現漲水過程2022-04-24
- 全省戰略性新興產業集群名單出爐,濮陽上榜2022-04-24