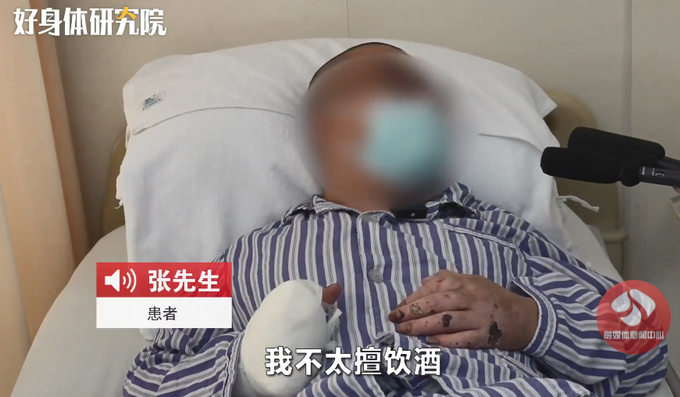
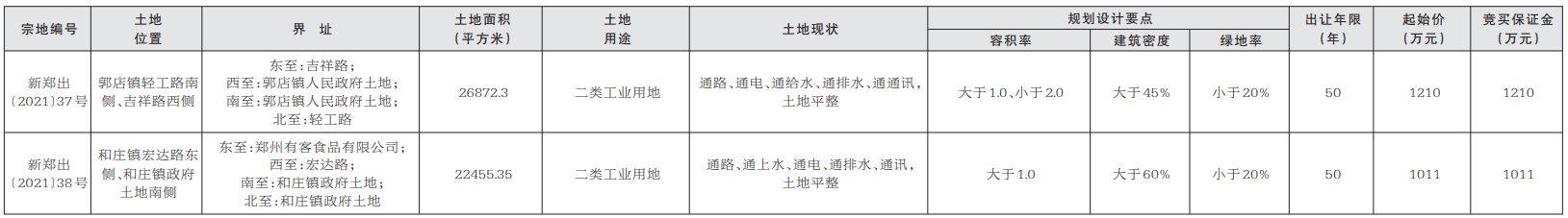
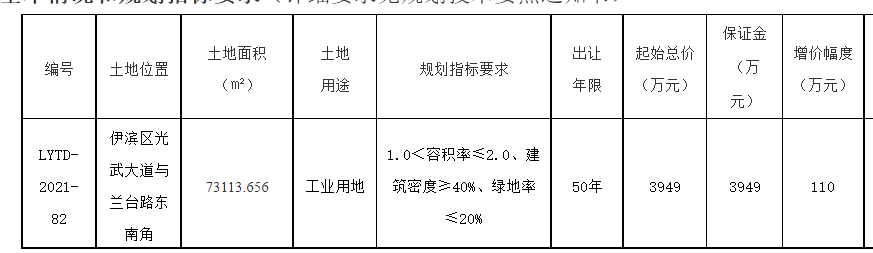
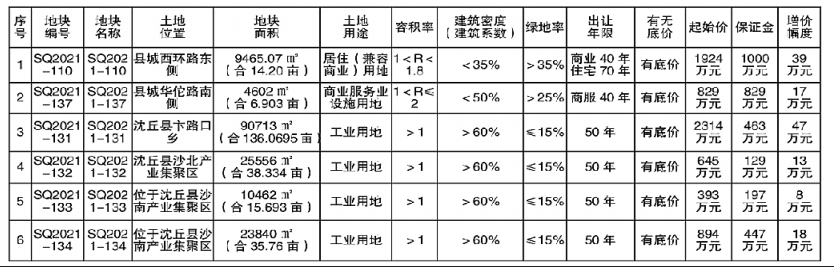
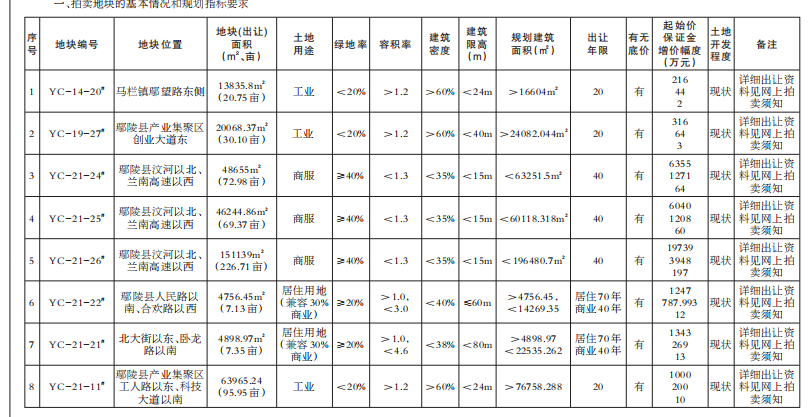
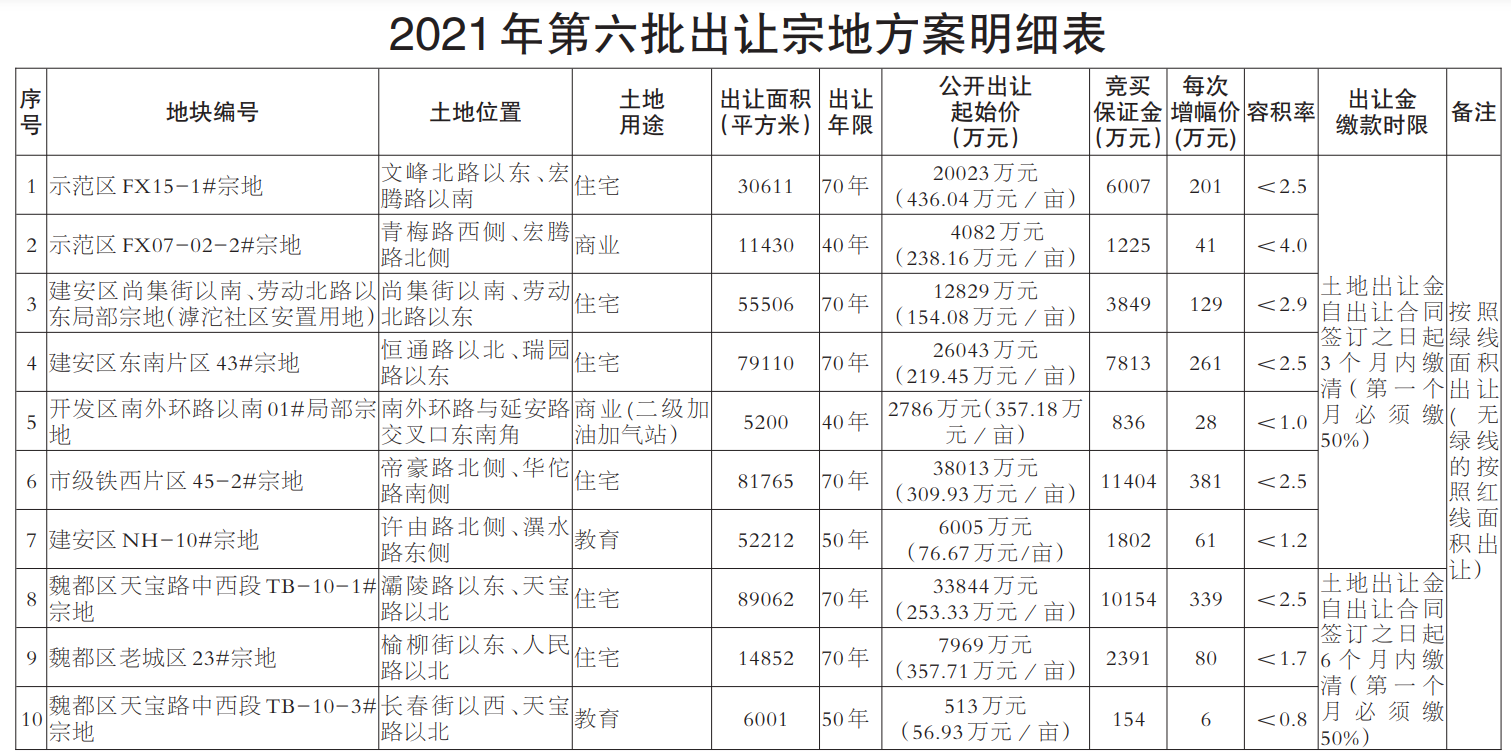
8月24日,記者從國家藥品監督管理局網獲悉,經四川省食品藥品檢驗檢測院等5家藥品檢驗機構檢驗,標示為通化中辰藥業有限責任公司等10家企業生產的10批次藥品不符合規定。
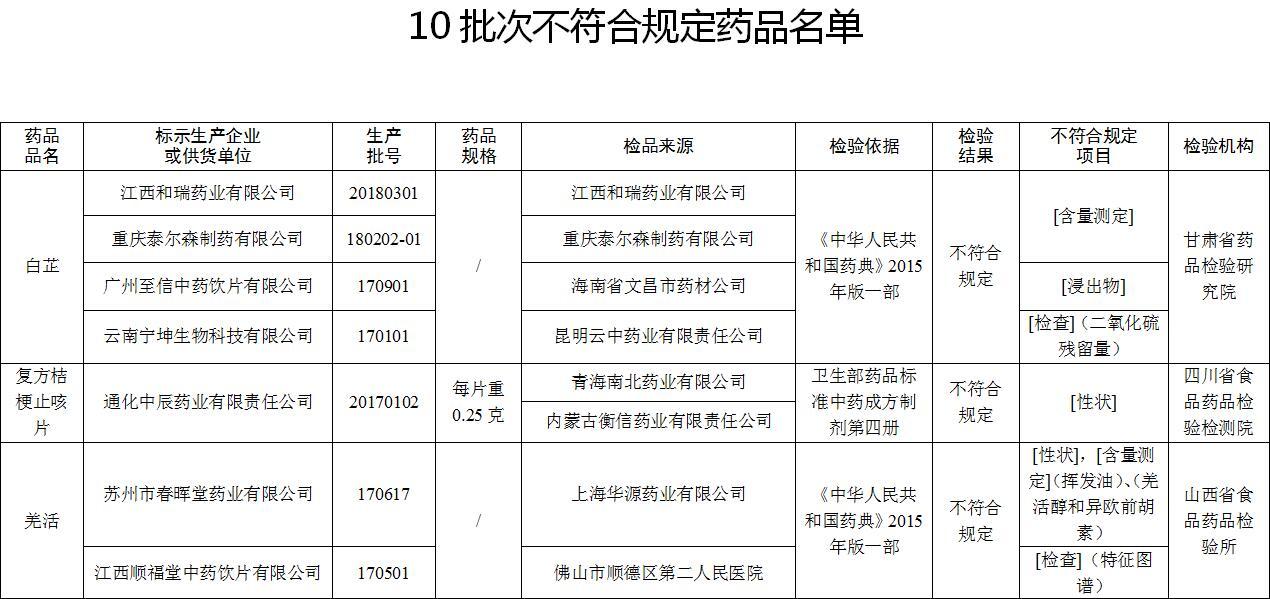
經甘肅省藥品檢驗研究院檢驗,標示為江西和瑞藥業有限公司、廣州至信中藥飲片有限公司、重慶泰爾森制藥有限公司、云南寧坤生物科技有限公司生產的4批次白芷不符合規定,不符合規定項目包括含量測定、浸出物、二氧化硫殘留量。
經四川省食品藥品檢驗檢測院檢驗,標示為通化中辰藥業有限責任公司生產的1批次復方桔梗止咳片不符合規定,不符合規定項目為性狀。
經山西省食品藥品檢驗所檢驗,標示為蘇州市春暉堂藥業有限公司、江西順福堂中藥飲片有限公司生產的2批次羌活不符合規定,不符合規定項目包括性狀、含量測定、特征圖譜。
經湖南省藥品檢驗研究院檢驗,標示為甘肅省西峰制藥有限責任公司生產的1批次維U顛茄鋁膠囊不符合規定,不符合規定項目為含量測定。
經北京市藥品檢驗所檢驗,標示為國藥集團致君(深圳)制藥有限公司(原深圳致君制藥有限公司)、國藥集團威奇達藥業有限公司生產的2批次注射用頭孢呋辛鈉不符合規定,不符合規定項目包括溶液的顏色、裝量差異。
對上述不符合規定藥品,相關藥品監督管理部門已采取查封、扣押等控制措施,要求企業暫停銷售使用、召回產品,并進行整改。
國家藥品監督管理局要求,相關省級藥品監督管理部門對上述企業和單位依據《中華人民共和國藥品管理法》第七十三、七十四、七十五條等規定對生產銷售假劣藥品的違法行為進行立案調查,自收到檢驗報告書之日起3個月內完成對相關企業或單位的調查處理并公開處理結果。
-
美國爸爸輔導孩子寫漢字氣到崩潰一行字寫了3小時!網友:這跟國籍無關
頭條 22-01-20
-
絕望! 女子隔離14天通過監控看狗子把家拆完 網友:感到“崩潰”
頭條 22-01-20
-
遼寧沈陽男子冬天醉臥路邊凍掉4根手指!網友:多虧被人發現
頭條 22-01-18
-
重慶一孕婦剪毀婚慶店內32件婚紗禮服當事人發文
頭條 22-01-17
-
中國空間站與國際空間站一張對比圖火了 網友直呼:畫面引起舒適
頭條 22-01-13
-
辟謠!800多人被拉定邊沙漠去隔離?西安網警:假的!
頭條 22-01-11
-
生日蛋糕上插滿課本男孩崩潰大哭 媽媽:想提醒他好好復習
頭條 22-01-11
-
男子地鐵摸女性屁股被扇3分鐘耳光?警方通報
頭條 22-01-06
-
天津高速現駝鳥奔跑 官方回應:系車主運輸途中不慎掉落已被車主領回
頭條 22-01-05
-
長得挺特別!菠蘿味草莓一斤150元 網友:直接買個菠蘿吃不好嗎
頭條 22-01-05
-
“秦始皇”做核酸珍貴畫面流出?逗樂網友!調侃:“秦始皇也要核酸了!”
頭條 21-12-31
-
985大學碩士媽媽吐槽兒子是學渣:他爸氣得2次心梗!以后只希望孩子健康成長
頭條 21-12-31
-
查干湖“頭魚”拍出299.9999萬的天價!網友:怎么吃才體現它的身價
頭條 21-12-29
-
村主任用灑水車向攤位噴水?官方回應:責令其辭去村委會主任職務
頭條 21-12-27
-
“外教辱罵防疫人員”,西安警方回應:已成立工作專班進行調查
頭條 21-12-27
-
破防了!91歲奶奶和8歲貓咪的對話讓人淚崩 網友:祝愿老人健康長壽
頭條 21-12-23
-
5歲女童配合消防員教科書式自救 網友點贊:很勇敢!
頭條 21-12-23
-
大爺被困電梯淡定嘮嗑等救援 網友:為大爺的冷靜沉著點贊!
頭條 21-12-22
-
男子4萬元存款18年后卻被銀行告知存款已被支取僅剩10塊錢 法院:銀行賠!
頭條 21-12-20
-
深圳一男子加油站拔油槍點燃后逃跑 警方已介入調查縱火人員已鎖定
頭條 21-12-17
-
這位感動千萬抖音網友的河南“留蝦女孩” 入選央視年度短片《2021看見笑容》
頭條 21-12-17
-
淚目!95歲媽媽病床前親吻74歲生病的女兒 網友:孩子不管多大都是媽媽的寶貝
頭條 21-12-15
-
川妹子抽中50顆榴蓮直呼吃不完!網友:可以共享你的負擔嗎?
頭條 21-12-15
-
河南省政府發布2022年元旦放假通知
頭條 21-12-15
-
濮陽市聚碳新材料產業聯盟成立
頭條 21-12-15
-
周口機場預計什么時候建好?都有到哪些城市的航線?官方回復來了
頭條 21-12-15
-
預計明年超50家企業回歸,瑞銀稱中概股H股上市將繼續升溫
頭條 21-12-15
-
新鄉發現一境外輸入奧密克戎病例密接者,活動軌跡公布
頭條 21-12-15
-
河南:中藥配方顆粒不得在醫療機構以外銷售
頭條 21-12-15
-
中原環保完成發行5億元超短融,利率2.95%
頭條 21-12-15
-
南陽市政府將與中車四方所在新能源裝備等領域開展深入合作
頭條 21-12-15
-
鄭州出臺新措施:公租房可“掌上”繳租秒辦理
頭條 21-12-15
-
國家統計局:11月社會消費品零售總額增長3.9%
頭條 21-12-15
-
中國11月規上工業增加值同比增長3.8%
頭條 21-12-15
-
1207萬!全年就業超額完成預期目標
頭條 21-12-15
-
河南凱旺科技公開發行2396萬股新股,獲6321.47倍申購
頭條 21-12-15
-
事關貨幣政策、房地產、全面注冊制,一行兩會劃定明年工作重點
頭條 21-12-15
-
隔夜歐美·12月15日
頭條 21-12-15
-
多部委密集部署明年工作!三大看點值得關注
頭條 21-12-15
-
立方風控鳥·早報(12月15日)
頭條 21-12-15
-
醫藥巨頭今日登陸科創板!高瓴重倉"陪伴",引入"綠鞋"機制
頭條 21-12-15
-
皮海洲:臨門一腳踏剎車!龍竹科技終止轉板說明了什么
頭條 21-12-15
-
立方風控鳥·晚報(12月14日)
頭條 21-12-14
-
成渝地區雙城經濟圈建設2022年擬推進160個重大項目,投資約2萬億元
頭條 21-12-14
-
總投資額超百億!中建七局接連中標兩個EPC總承包項目
頭條 21-12-14
-
2022年部分地方債提前下達,財政提前發力穩經濟
頭條 21-12-14
-
信陽華信投資集團10億元中票完成發行,利率3.70%
頭條 21-12-14
-
新強聯擬擇機出售所持明陽智能股票
頭條 21-12-14
-
洛陽新強聯擬億元入股山東擬IPO公司,持股4.50%
頭條 21-12-14
-
焦作在這場推介會上現場簽約28個項目,總投資240億元
頭條 21-12-14
-
河南7種輕微交通違法可免罰
頭條 21-12-14
-
廣州高校發現古墓考古專業出動!網友:這不巧了嘛!畢業論文自己找來了
頭條 21-12-14
-
浙江樂清民警自曝37歲未婚救下輕生女子 網友:一定要最愛自己
頭條 21-12-14
-
畫面感太強!主人出差貓咪打開水龍頭把家淹了 網友:當然是原諒它
頭條 21-12-09
-
8歲雙胞胎姐妹玩捉迷藏撿到20萬擺地攤媽媽報警找失主 網友紛紛點贊
頭條 21-12-08
- 民航局對這兩個國際航班實施熔斷措施2022-01-21
- 云南勐臘通報2例本土無癥狀感染者活動軌跡2022-01-21
- 河南昨日新增本土確診病例3例,自1月5日以2022-01-21
- 美國政府將派發4億只N95口罩 每人限領3只2022-01-21
- 廣東省新增本土確診病例4例,均為珠海報告2022-01-21
- 六項舉措 做好春節期間務工人員流動相關工2022-01-21
- 山東日照通報一醫生直播婦科手術問題處置情2022-01-21
- 天津市新增8例本土新冠肺炎確診病例2022-01-21
- 堅定主心骨 匯聚正能量 為實現“兩個確保2022-01-21
- 河南院校類職業技能等級認定機構備案工作開2022-01-21
- 開封市發布重要提醒!春節期間返汴人員請務2022-01-21
- 高速通行證如何領取?快速核酸檢測點都在哪2022-01-21
- 傾倒污染性土壤構成違法犯罪這類行為將重罰2022-01-21
- 《河南省省直機關公務出行租賃社會車輛管理2022-01-21
- 今年春節鄭州街頭不再掛彩燈!主要有三個原2022-01-21
- 安陽開辟抗疫人員工傷綠色通道 確保依法及2022-01-21
- 河南省級融資擔保代償補償資金池年度賬單出2022-01-21
- 河南發文了!疫情防控期間確保生活物資應急2022-01-21
- 鄭州市發布2022年27號通告:部分區域疫情風2022-01-21
- 鄭州148支(31339人)專業隊伍 全力保通城2022-01-21
- 春節期間河南省人社廳等十部門聯動服務務工2022-01-21
- 春節腳步臨近 各大商超備貨充足迎新春2022-01-21
- 注意防范!鄭州剛剛發布道路結冰黃色預警2022-01-21
- 提醒!鄭州西南繞城高速禁止所有車輛上站2022-01-21
- 河南啟動低溫雨雪冰凍災害Ⅳ級應急響應2022-01-21
- 各地最新返鄉政策來了!回家前旅途中到家后2022-01-21
- 駐馬店發布2022年第5號通告:公布最新入駐2022-01-21
- 商丘市發布最新通告:有序恢復公共交通運營2022-01-21
- @司機朋友 春運啟動鄭州交警嚴查這幾類交2022-01-21
- “我錢都去哪了?”2021年居民消費榜告訴你2022-01-21