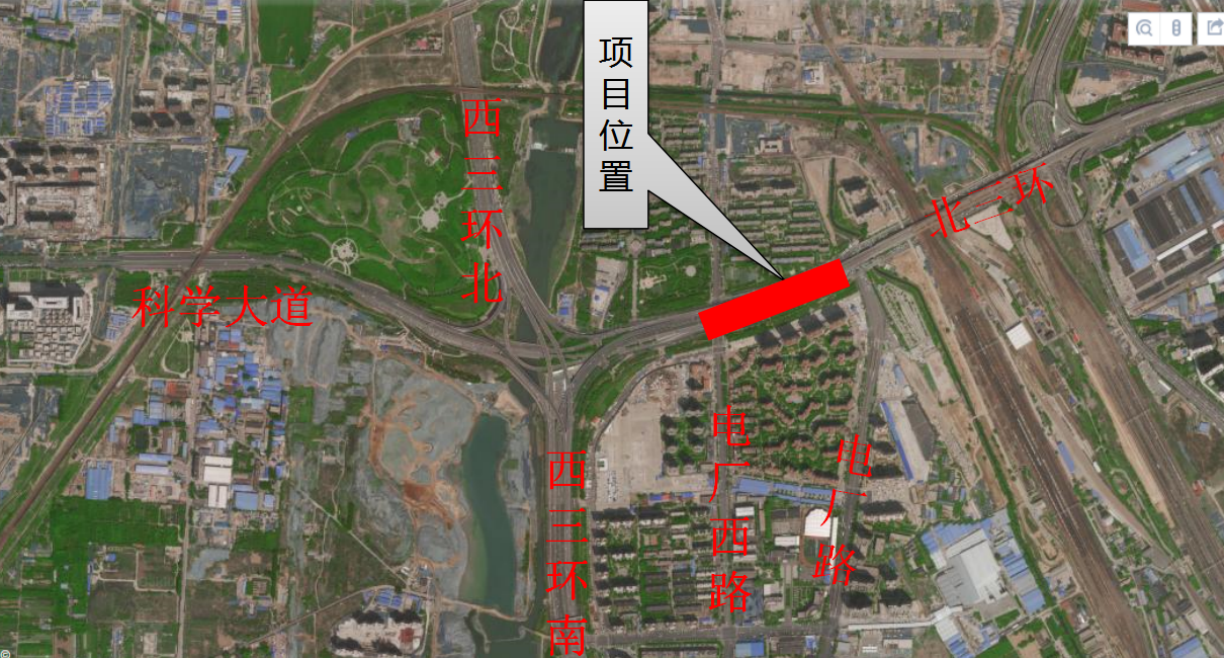
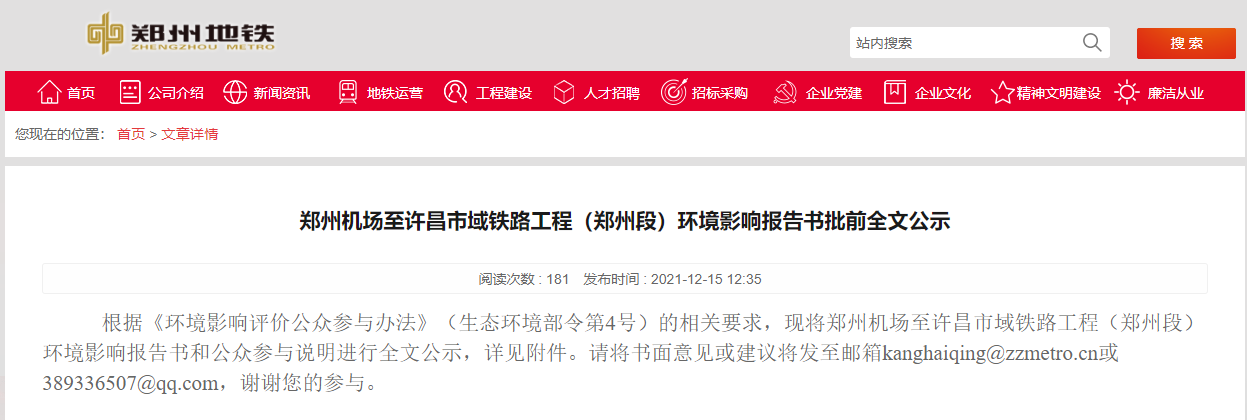
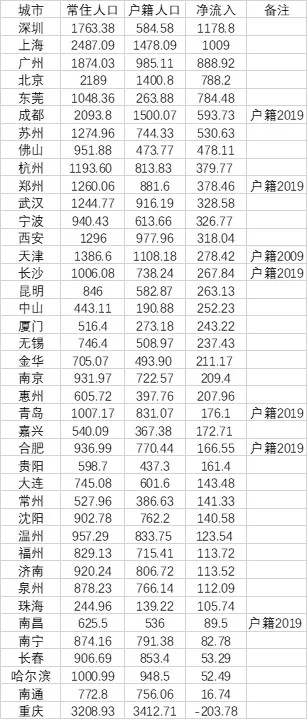
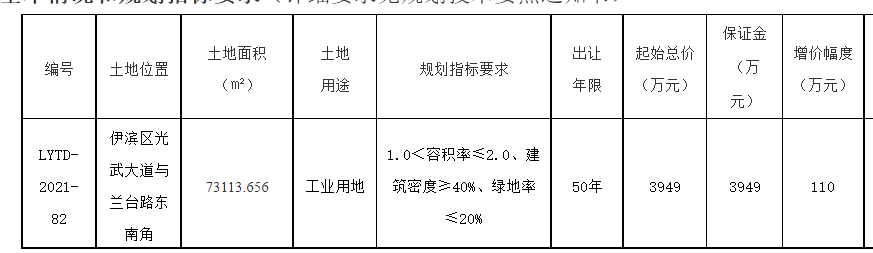
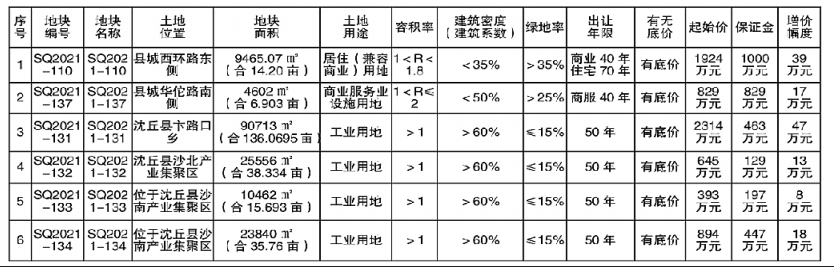
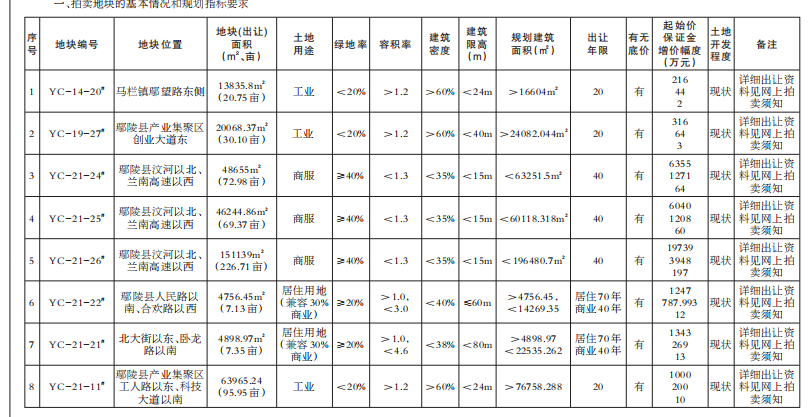
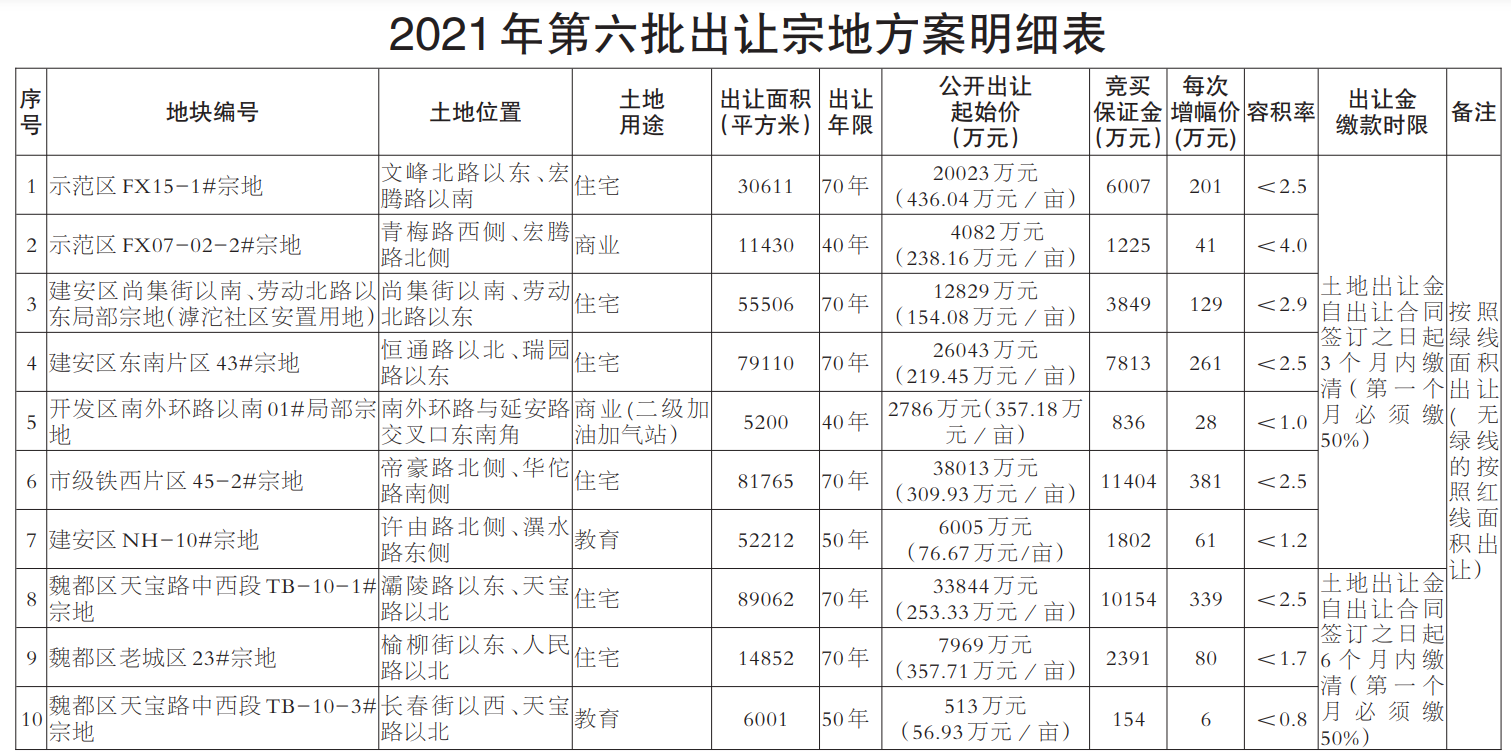
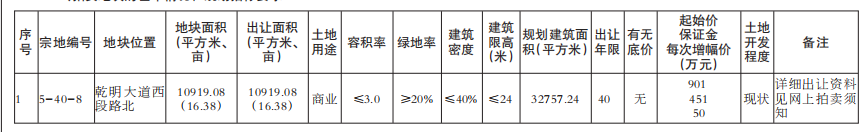
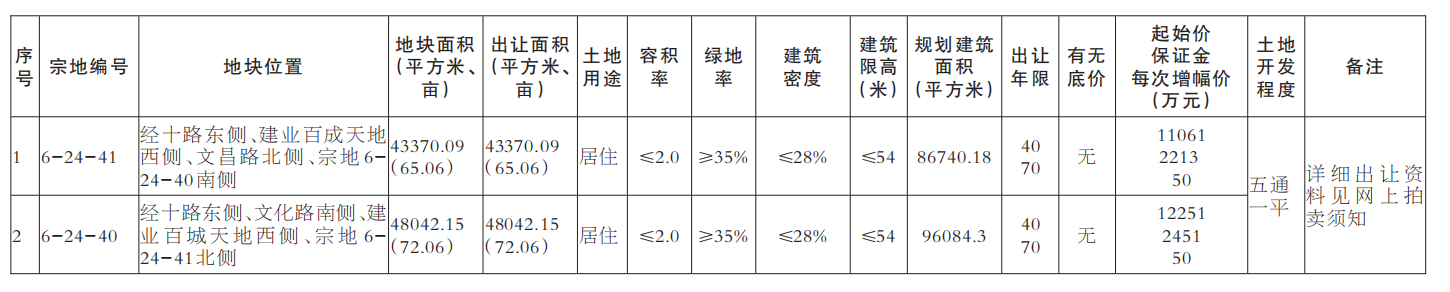
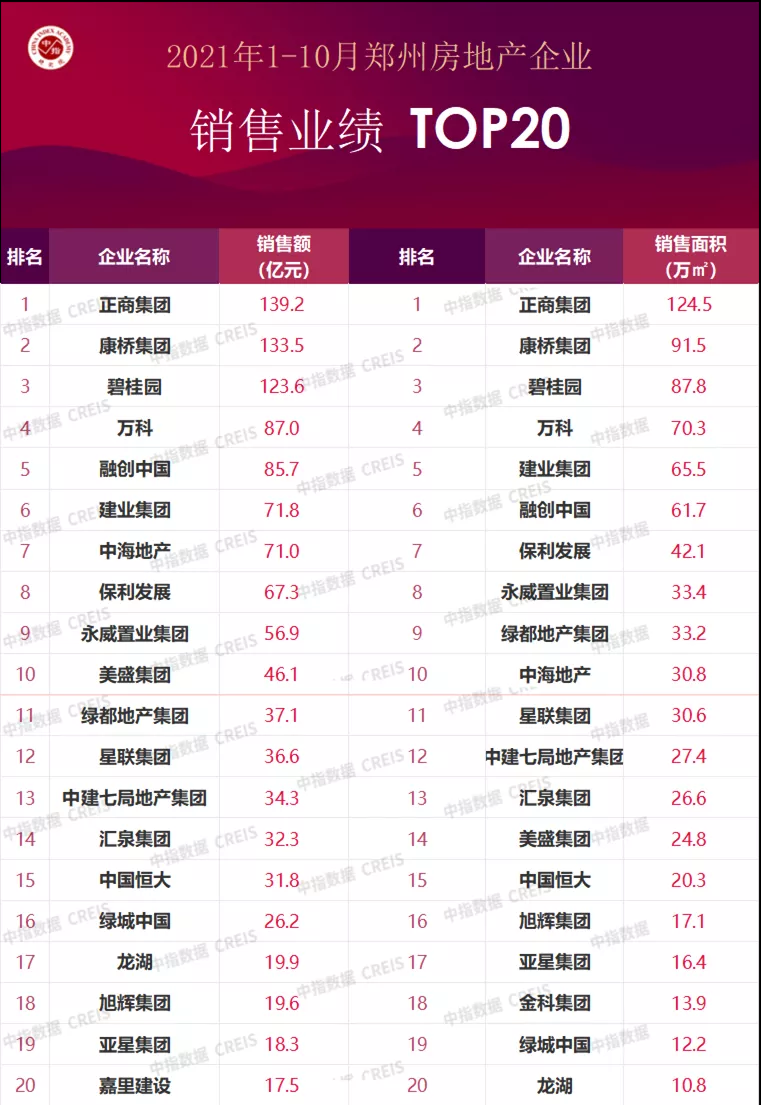
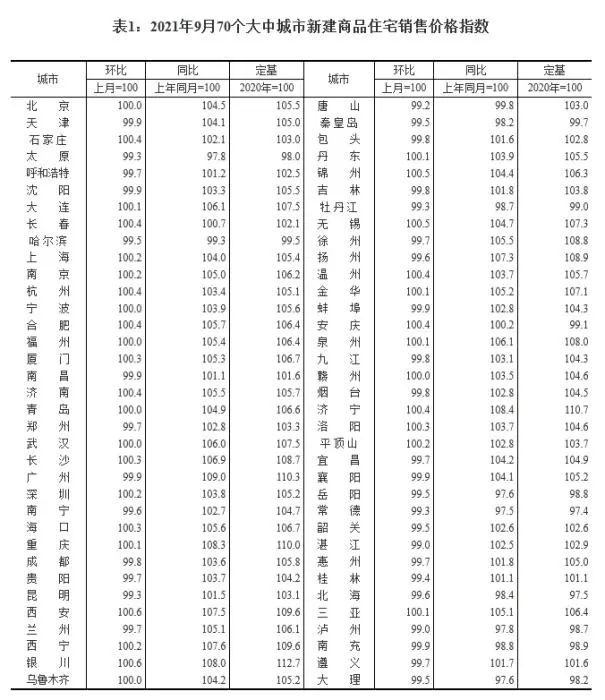
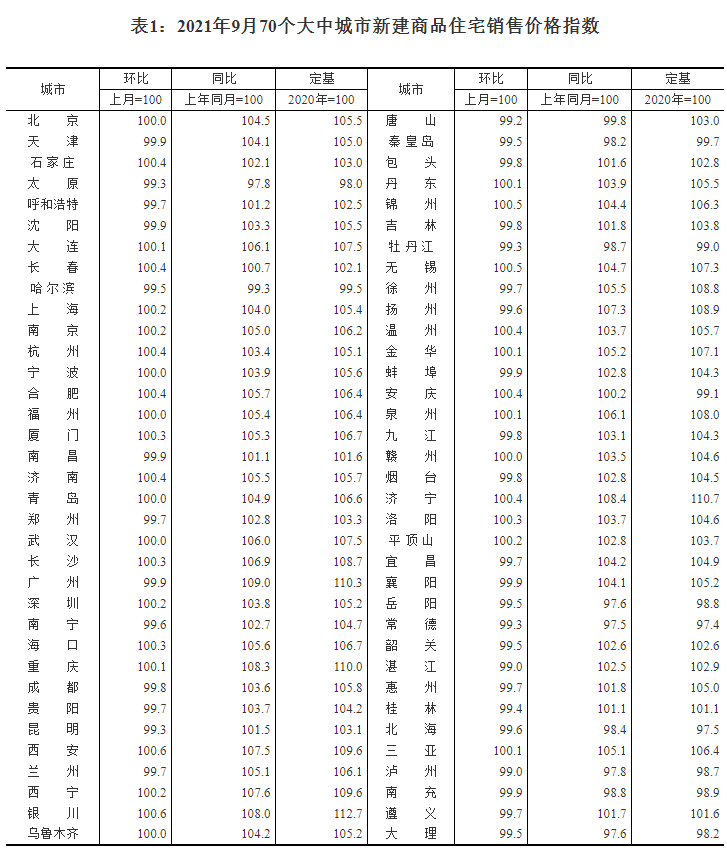
近日,藥品審評中心在其網站公示兩批共36個擬進行優先審評藥品品種名單。
其中,宜昌人福藥業有限責任公司注冊申請的注射用苯磺酸瑞馬唑侖、百濟神州(蘇州)生物科技有限公司注冊申請的贊布替尼膠囊、上海綠谷制藥有限公司注冊申請的甘露寡糖二酸膠囊、正大天晴藥業集團股份有限公司注冊申請的鹽酸安羅替尼膠囊、江蘇恒瑞醫藥股份有限公司注冊申請的苯磺順阿曲庫銨注射液等23個品種公示截止日期為2018年12月29日;南京先聲東元制藥有限公司注冊申請的依達拉奉右旋莰醇注射液、廣東東陽光藥業有限公司注冊申請的奧氮平口崩片、浙江華海藥業股份有限公司注冊申請的替米沙坦氫氯噻嗪片、衛材(中國)藥業有限公司注冊申請的吡侖帕奈片、吉利德(上海)醫藥科技有限公司注冊申請的比克替拉韋/恩曲他濱/丙酚替諾福韋片等13個品種公示截止日期為2019年1月2日。
2016年,原國家食品藥品監管總局出臺《關于解決藥品注冊申請積壓實行優先審評審批的意見》,將多種情況納入優先審評范圍,其中包括防治艾滋病、肺結核、病毒性肝炎、罕見病、惡性腫瘤的藥物以及兒童老人急需的“救命藥”的注冊申請。
截至2018年8月,藥審中心已公開發布31批410個列入優先審評審批的品種。這意味著,越來越多的臨床“救命藥”將通過優先審評渠道批準上市,應用于臨床。(記者竇潔)
-
深圳一男子加油站拔油槍點燃后逃跑 警方已介入調查縱火人員已鎖定
頭條 21-12-17
-
這位感動千萬抖音網友的河南“留蝦女孩” 入選央視年度短片《2021看見笑容》
頭條 21-12-17
-
淚目!95歲媽媽病床前親吻74歲生病的女兒 網友:孩子不管多大都是媽媽的寶貝
頭條 21-12-15
-
川妹子抽中50顆榴蓮直呼吃不完!網友:可以共享你的負擔嗎?
頭條 21-12-15
-
河南省政府發布2022年元旦放假通知
頭條 21-12-15
-
濮陽市聚碳新材料產業聯盟成立
頭條 21-12-15
-
周口機場預計什么時候建好?都有到哪些城市的航線?官方回復來了
頭條 21-12-15
-
預計明年超50家企業回歸,瑞銀稱中概股H股上市將繼續升溫
頭條 21-12-15
-
新鄉發現一境外輸入奧密克戎病例密接者,活動軌跡公布
頭條 21-12-15
-
河南:中藥配方顆粒不得在醫療機構以外銷售
頭條 21-12-15
-
中原環保完成發行5億元超短融,利率2.95%
頭條 21-12-15
-
南陽市政府將與中車四方所在新能源裝備等領域開展深入合作
頭條 21-12-15
-
鄭州出臺新措施:公租房可“掌上”繳租秒辦理
頭條 21-12-15
-
國家統計局:11月社會消費品零售總額增長3.9%
頭條 21-12-15
-
中國11月規上工業增加值同比增長3.8%
頭條 21-12-15
-
1207萬!全年就業超額完成預期目標
頭條 21-12-15
-
河南凱旺科技公開發行2396萬股新股,獲6321.47倍申購
頭條 21-12-15
-
事關貨幣政策、房地產、全面注冊制,一行兩會劃定明年工作重點
頭條 21-12-15
-
隔夜歐美·12月15日
頭條 21-12-15
-
多部委密集部署明年工作!三大看點值得關注
頭條 21-12-15
-
立方風控鳥·早報(12月15日)
頭條 21-12-15
-
醫藥巨頭今日登陸科創板!高瓴重倉"陪伴",引入"綠鞋"機制
頭條 21-12-15
-
皮海洲:臨門一腳踏剎車!龍竹科技終止轉板說明了什么
頭條 21-12-15
-
立方風控鳥·晚報(12月14日)
頭條 21-12-14
-
成渝地區雙城經濟圈建設2022年擬推進160個重大項目,投資約2萬億元
頭條 21-12-14
-
總投資額超百億!中建七局接連中標兩個EPC總承包項目
頭條 21-12-14
-
2022年部分地方債提前下達,財政提前發力穩經濟
頭條 21-12-14
-
信陽華信投資集團10億元中票完成發行,利率3.70%
頭條 21-12-14
-
新強聯擬擇機出售所持明陽智能股票
頭條 21-12-14
-
洛陽新強聯擬億元入股山東擬IPO公司,持股4.50%
頭條 21-12-14
-
焦作在這場推介會上現場簽約28個項目,總投資240億元
頭條 21-12-14
-
河南7種輕微交通違法可免罰
頭條 21-12-14
-
廣州高校發現古墓考古專業出動!網友:這不巧了嘛!畢業論文自己找來了
頭條 21-12-14
-
浙江樂清民警自曝37歲未婚救下輕生女子 網友:一定要最愛自己
頭條 21-12-14
-
畫面感太強!主人出差貓咪打開水龍頭把家淹了 網友:當然是原諒它
頭條 21-12-09
-
8歲雙胞胎姐妹玩捉迷藏撿到20萬擺地攤媽媽報警找失主 網友紛紛點贊
頭條 21-12-08
-
女子9樓墜落緊緊抓住7樓防護窗所幸有驚無險!網友:不幸中的萬幸啊
頭條 21-12-07
-
江西一年級萌娃穿航天服走方陣 網友:可可愛愛的小小航天員
頭條 21-12-06
-
女子精心養了半年的盆栽竟是塑料做的 網友:這是做的有多真
頭條 21-11-30
-
河南鄭州一女子懷上八胞胎!醫生一句話說出罕見原因 全家又喜又憂
頭條 21-11-26
-
央視新聞AI手語主播正式亮相!網友:專業!第一反應就想到了朱廣權
頭條 21-11-25
-
網信辦:嚴防違法失德藝人“曲線復出” 營造積極健康向上的網絡環境
頭條 21-11-24
-
神奇!女子用砂鍋煮綠豆粥自動吐皮 網友:這個鍋好“懂事”
頭條 21-11-23
-
湖南一懷孕老師暈倒學生們立刻化身“閃電俠”飛奔相救
頭條 21-11-23
-
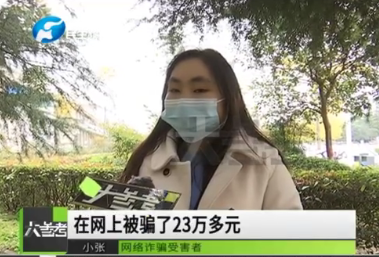
26歲癌癥女孩刷單被騙23萬救命錢 想掙外快結果救命錢打了水漂
頭條 21-11-23
-
河南鄭州六旬白發教授夜訪男寢教微積分:都追到宿舍再學不會就對不起老師
頭條 21-11-19
-
男子撿槍上交進門瞬間嚇壞警察迅速拔槍警戒 網友:進門倒是說一聲啊
頭條 21-11-19
-
硬核!男子酒后執意開車被兄弟卸掉輪胎 網友:這才是真朋友啊!
頭條 21-11-18
-
撒貝寧時隔4年回歸主持今日說法 網友激動喊話:“爺青回”
頭條 21-11-18
-
廣州一流浪貓被五星級酒店收留憑實力找到長期飯票 每天吃米其林星級員工餐
頭條 21-11-17
-
考研沖刺倒計時大學生拿燈管學習?消防員蜀黍順著網線找來了!
頭條 21-11-16
-
經商奇才!長春女子為南方人雪地代寫6天賺300元 網友:雪起碼得分三成
頭條 21-11-16
-
實用又好看!陜西渭南村民在院墻上栽滿仙人掌防盜 網友:真的很好看~
頭條 21-11-15
-
果農“為國家做研究”捐橘子 網店老板找到了!老板:大家理性消費
頭條 21-11-15
-
大烏龍!星空燈下男子捧花告白跪錯人 網友:社死現場!
頭條 21-11-15
- 內地奧運健兒與澳門青少年運動員開展對話交2021-12-20
- 香港中聯辦聲明:祝賀香港特區第七屆立法會2021-12-20
- 今日起 石家莊市區小學生和幼兒上下學免費2021-12-20
- 江西南昌殺妻拋尸案二審維持死刑:被告人主2021-12-20
- 山東通報關于藝考考生違規攜帶手機網傳試卷2021-12-20
- 戰鼓催征練兵急——第81集團軍某旅學習十九2021-12-20
- “十四五”縣域普通高中發展提升行動計劃 2021-12-20
- 《全國普通高校本科教育教學質量報告(20202021-12-20
- “中小學教師的負擔也要真的減下來” 教師2021-12-20
- 鄭濟高鐵鄭濮段首個動力“心臟”送電 其他2021-12-20
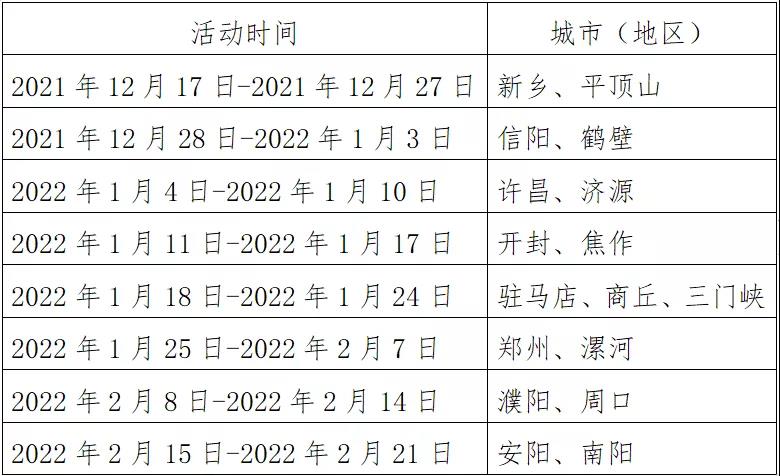
- 河南印發緊急通知 即日起至明年2月底開展2021-12-20
- 降溫!暴雪!本周河南氣溫將出現今年入冬以2021-12-20
- 綠維文旅:土地開發與運營要點2021-12-20
- 顛覆級豪華改裝登場,風行M7領爵款演繹豪華2021-12-20
- 借力清華大學課題研究 顧家家居與高校年輕2021-12-20
- 14萬起售即豪華,進階MPV世家煥新力作東風2021-12-20
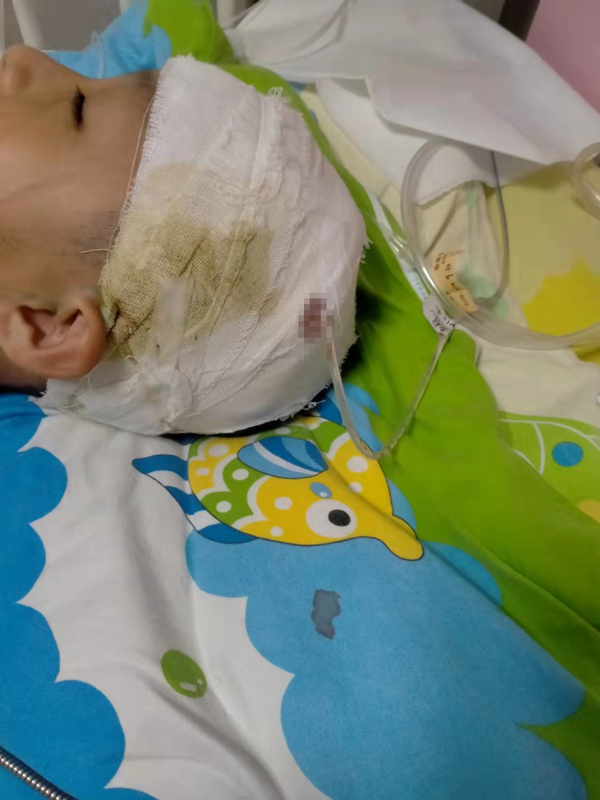
- 周口小學生被校長拍打頭部后病發 校長是否2021-12-20
- 太揪心!山西孝義透水事故獲救人員講述被困2021-12-20
- 國家衛健委:昨日新增本土確診病例37例,其2021-12-20
- 浙江省新增確診病例12例,其中杭州市1例、2021-12-20
- 浙江昨日新增本土確診病例10例 境外輸入確2021-12-20
- 內蒙古昨日新增境外輸入確診病例7例2021-12-20
- 香港特區政府新聞公報:行政長官林鄭月娥將2021-12-20
- 河南高純石英砂提純技術獲突破 提純二氧化2021-12-20
- 鄭州一年內新增易貨公司100多家 靠收服務2021-12-20
- 出山店水庫移民安置工作通過國家驗收 歷時2021-12-20
- 鶴壁辛村遺址發現殷遺民貴族墓葬2021-12-20
- 河南省《通知》 確定175家企業為知識產權2021-12-20
- 河南出臺《方案》 到2025年公民具備科學素2021-12-20
- 11月份河南全省經濟運行情況發布 新興動能2021-12-20